แรงแวนเดอวาลล์ (Van der Waals forces) จัดเป็นแรงระหว่างโมเลกุลมีความแข็งแรงน้อยกว่าพันธะไฮโดรเจน(Hydrogen bonding)ซึ่งแบ่งเป็นสามประเภทคือ แรงลอนดอน (London dispersion forces) แรงดึงดูดระหว่างขั้ว(Dipole-dipole forces)และแรงดึงดูดไอออนกับขั้ว(Ion-dipole forces)
-แรงลอนดอน (London
dispersion force) จัดเป็น แรงที่มีความแข็งแรงน้อยที่สุดในชนิดของแรงแวนเดอวาลล์ จึงต้องการพลังงานในการสลายพันธะหรือแรงระหว่างโมเลกุลน้อยมาก โมเลกุลที่ยึดจับกันด้วยแรงชนิดนี้มีจุดเดือด และจุดหลอม เหลวต่ำมาก
dispersion force) จัดเป็น แรงที่มีความแข็งแรงน้อยที่สุดในชนิดของแรงแวนเดอวาลล์ จึงต้องการพลังงานในการสลายพันธะหรือแรงระหว่างโมเลกุลน้อยมาก โมเลกุลที่ยึดจับกันด้วยแรงชนิดนี้มีจุดเดือด และจุดหลอม เหลวต่ำมาก
โดยปกติโมเลกุลที่ไม่มีขั้วจะประพฤติตัวเป็นกลางในบางครั้งอิเล็กตรอนเคลื่อนที่ไปรวมอยู่ด้านใดด้านหนึ่งของอะตอมหรือโมเลกุลทำให้เกิดสภาพขั้วชั่วคราวขึ้น โดยตำแหน่งที่อิเล็กตรอนเคลื่อนที่ไปรวมกันจะเกิดสภาพที่เป็นประจุลบ (d-) และตำแหน่งที่ไม่มีอิเล็กตรอนจะเกิดสภาพประจุที่เป็นบวก (d+)

โมเลกุลที่มีสภาพขั้วแบบชั่วคราวสามารถเหนี่ยวนำทำให้โมเลกุลในสภาวะปกติมีสภาพขั้วโดยที่ตำแหน่งที่มีอิเล็กตรอนหนาแน่นมีประจุเป็นลบจะไปผลักอิเล็กตรอนของอีกโมเลกุลให้ไปอยู่ด้านตรงข้ามทำให้เกิดอีกโมเลกุลมีสภาวะขั้วชั่วคราวอีกโมเลกุล ทำให้โมเลกุลทั้งสองมีประจุบวกและลบเรียกว่า Polarizability และเกิดแรงดึงดูดระหว่างประจุบวกและลบ ซึ่งแรงดึงดูดที่เกิดขึ้นดังลักษณะนี้เราเรียกว่า แรงลอนดอน (London dispersion force)
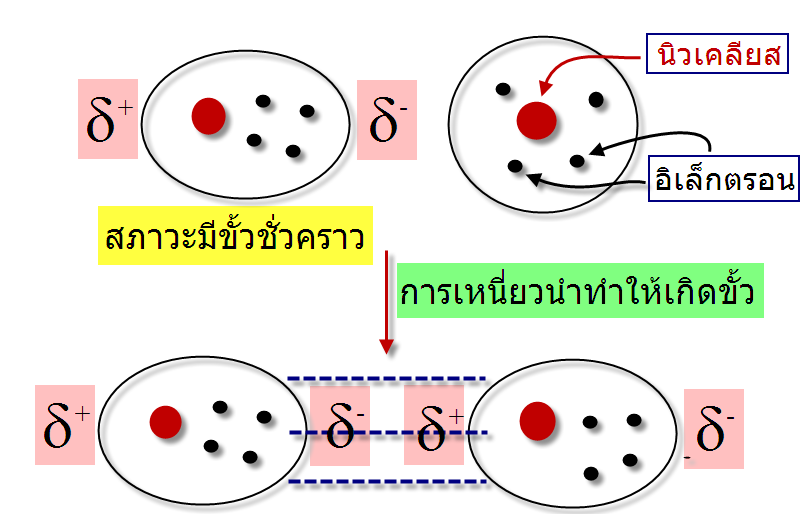
แรงที่เกิดขึ้นนี้เกิดจากการที่อิเล็กตรอนเคลื่อนที่ไปรวมอยู่ด้านใดด้านหนึ่งของโมเลกุลทำให้เกิดสภาพขั้วชั่วคราวขึ้น และไม่สามารถเกิดขึ้นแบบถาวรจึงมีความแข็งแรงจึงน้อยมาก
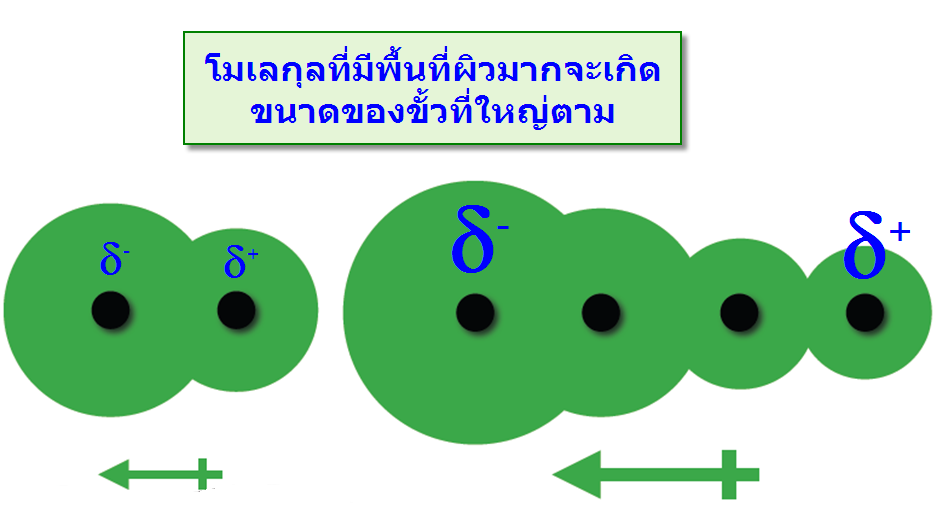
พบว่าเมื่อโมเลกุลหรืออะตอมมีขนาดใหญ่ขึ้นจะมีความสามารถทำให้เกิดขั้ว(Polarizability) ได้ ง่าย เนื่องจากเมื่ออิเล็กตรอนเคลื่อนที่ไปรวมที่ตำแหน่งใดตำแหน่งหนึ่งดังรูป พบว่าในกรณีโมเลกุลขนาดใหญ่จะมีความแตกต่างระหว่างขั้วมากกว่าจึงทำให้เกิดแรงดึงดูดระหว่างขั้วที่มากกว่าเช่นกัน ดังตัวอย่าง Cl2 และBr2 พบว่าBr2 มีขนาดใหญ่กว่าจึงมีแรงดึงดูดระหว่างโมเลกุลมากกว่าทำให้จุดเดือดและจุดหลอมเหลวมากกว่<="" span="" lang="TH">าCl2
-พื้นที่ผิวของโมเลกุล : โมเลกุลที่มีพื้นที่ผิวมากจะทำให้ขนาดของประจุมีขนาดใหญ่ตาม เมื่อเปรียบเทียบสถานะของ Neopentaneและ n-Pentaneพบว่าที่อุณหภูมิห้องNeopentane มีสมบัติเป็นก๊าซ แต่ n-Pentaneเป็นของเหลว แสดงว่า n-Pentane มีแรงระหว่าโมเลกุลมากกว่า Neopentaneทั้งนี้เป็นเพราะn-Pentaneมีพื้นที่ผิวมากกว่าทำให้ประจุที่เกิดขึ้นมีขนาดใหญ่ แรงระหว่างพันธะจึงมากตามไปด้วย
-แรงดึงดูดระหว่างขั้ว (Dipole -dipole forces) จัดเป็นแรงที่เกิดจากขั้วถาวรดึงดูดกันเองระหว่างขั้วบวกและขั้วลบซึ่งดึงดูดได้สองแบบดังตัวอย่างของอะซิโตน
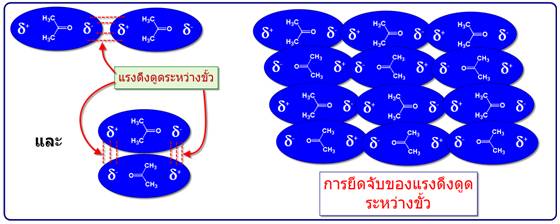
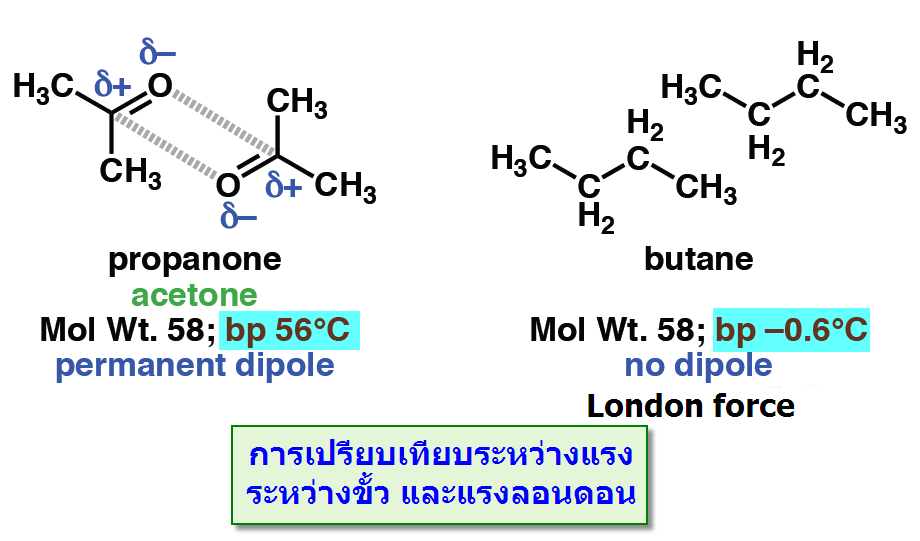
เมื่อนำมาเปรียบเทียบระหว่างแรงดึงดูดระหว่างขั้ว(Dipole -dipole forces) กับ แรงลอนดอน (London
dispersion forces)
โดยที่โมเลกุลมีขนาดพอๆกัน พบว่าแรงดึงดูดระหว่างขั้วมีความแข็งแรงมากกว่าดังตัวอย่างของ อะซิโตน มีจุดเดือดเท่ากับ 56 oC กับ Butaneมีจุดเดือดเท่ากับ -0.6 oC (พิจารณาจากสารประกอบที่มีจุดเดือดสูงกว่าต้องมีแรงระหว่างโมเลกุลมากกว่า)
dispersion forces)
โดยที่โมเลกุลมีขนาดพอๆกัน พบว่าแรงดึงดูดระหว่างขั้วมีความแข็งแรงมากกว่าดังตัวอย่างของ อะซิโตน มีจุดเดือดเท่ากับ 56 oC กับ Butaneมีจุดเดือดเท่ากับ -0.6 oC (พิจารณาจากสารประกอบที่มีจุดเดือดสูงกว่าต้องมีแรงระหว่างโมเลกุลมากกว่า)
- แรงดึงดูดระหว่างไอออนกับขั้ว(Ion-dipole
forces) เป็นแรงที่เกิดจากไอออนกับสารประกอบที่มีขั้วจัดเป็นแรงที่มีความแข็งแรงมากกว่าแรงระหว่างขั้ว(Dipole-dipole forces)เช่นการละลายของ NaCl ใน น้ำ Na+ที่มีประจุเป็นบวกจะเกิดแรงดึง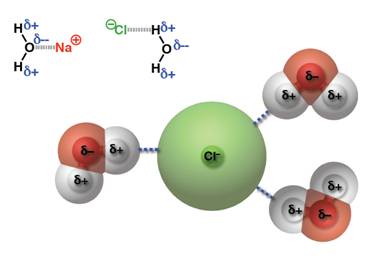 ดูดกับออกซิเจนซ์ของน้ำ และ Cl- จะเกิดแรงดึงดูดกับ H ของน้ำเช่นกัน ดังตัวอย่าง
ดูดกับออกซิเจนซ์ของน้ำ และ Cl- จะเกิดแรงดึงดูดกับ H ของน้ำเช่นกัน ดังตัวอย่าง
forces) เป็นแรงที่เกิดจากไอออนกับสารประกอบที่มีขั้วจัดเป็นแรงที่มีความแข็งแรงมากกว่าแรงระหว่างขั้ว(Dipole-dipole forces)เช่นการละลายของ NaCl ใน น้ำ Na+ที่มีประจุเป็นบวกจะเกิดแรงดึง
 ดูดกับออกซิเจนซ์ของน้ำ และ Cl- จะเกิดแรงดึงดูดกับ H ของน้ำเช่นกัน ดังตัวอย่าง
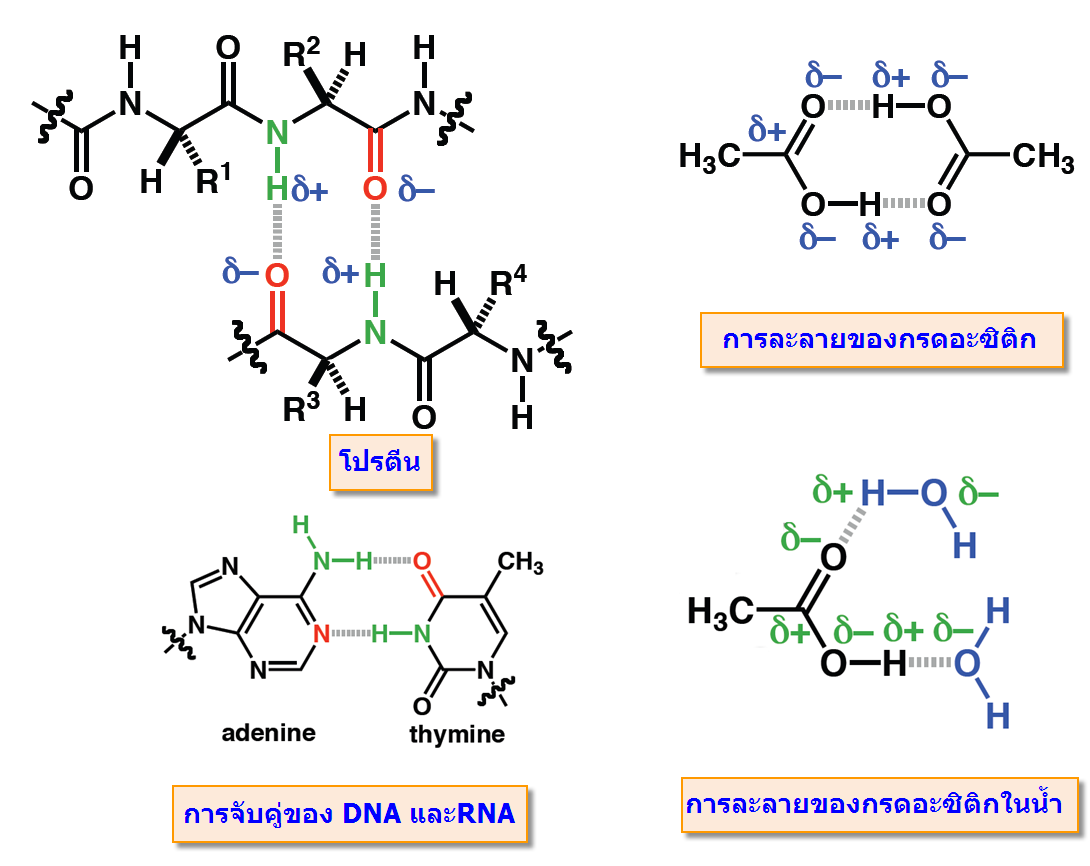
ดูดกับออกซิเจนซ์ของน้ำ และ Cl- จะเกิดแรงดึงดูดกับ H ของน้ำเช่นกัน ดังตัวอย่าง-พันธะโฮโดรเจน(Hydrogen bonding) จัดเป็นพันธะที่แข็งแรงมากที่สุดในพันธะระหว่างโมเลกุลเกิดระหว่างอะตอมของ H และ อะตอมที่มีค่า EN สูง F, O, N
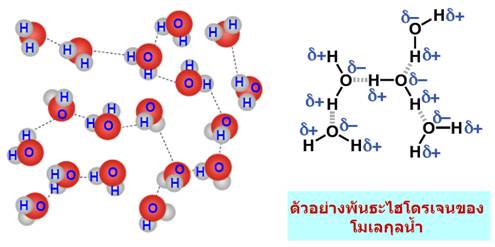
พันธะโฮโดรเจน(Hydrogen bonding) มีบทบาทสำคัญกับขบวนการที่สำคัญของสิ่งมีชีวิตไม่ว่าเป็นการจับกันระหว่างโมเลกุลของโปรตีนและการจับเข้าคู่กับของ DNAและRNA