1. พันธะเดี่ยว (Single covalent bond )เกิดจากการใช้อิเล็กตรอนร่วมกัน 1 อิเล็กตรอน เช่น F2 Cl2 CH4 เป็นต้น

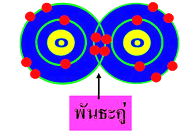
2. พันธะคู่ ( Doublecovalent bond ) เกิดจากการใช้อิเล็กตรอนร่วมกันของธาตุทั้งสองเป็นคู่ หรือ 2 อิเล็กตรอน เช่น O2 CO2 C2H4 เป็นต้น
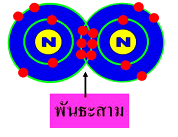
3. พันธะสาม ( Triple covalent bond ) เกิดจากการใช้อิเล็กตรอนร่วมกัน 3 อิเล็กตรอน ของธาตุทั้งสอง เช่น N2 C2H2 เป็นต้น
การอ่านชื่อสารประกอบโควาเลนซ์
์
- สารประกอบของธาตุคู่ ให้อ่านชื่อธาตุที่อยู่ข้างหน้าก่อน แล้วตามด้วยชื่อธาตุที่อยู่หลัง โดยเปลี่ยนเสียงพยางค์ท้ายเป็น “ ไอด์” (ide)
- ให้ระบุจำนวนอะตอมของแต่ละธาตุด้วยเลขจำนวนในภาษากรีก ดังตาราง
- ถ้าสารประกอบนั้นอะตอมของธาตุแรกมีเพียงอะตอมเดียว ไม่ต้องระบุจำนวนอะตอมของธาตุนั้น แต่ถ้าเป็นอะตอมของธาตุหลังให้อ่าน “ มอนอ” เสมอ

โมเลกุลโควาเลนต์ในสามมิตินั้น สามารถพิจารณาได้จากการผลักกันของอิเล็กตรอนที่มีอยู่รอบๆ อะตอมกลางเป็นสำคัญ โดยอาศัยหลักการที่ว่า อิเล็กตรอนเป็นประจุลบเหมือนๆ กัน ย่อมพยายามที่แยกตัวออกจากกนให้มากที่สุดเท่าที่จะกระทำได้ ดังนั้นการพิจารณาหาจำนวนกลุ่มของอิเล็กตรอนที่อยู่รอบๆ นิวเคลียสและอะตอมกลาง จะสามารถบ่งบอกถึงโครงสร้างของโมเลกุลนั้น ๆ ได้ โดยที่กลุ่มต่างๆ มีดังนี้
- อิเล็กตรอนคู่โดดเดี่ยว
- อิเล็กตรอนคู่รวมพันธะได้แก่ พันธะเดี่ยว พันธะคู่ และพันธะสาม
ทั้งนี้โดยเรียงตามลำดับความสารารถในการผลักอิเลคตรอนกลุ่มอื่นเนื่องจาก อิเลคตรอนโดดเดี่ยวและอิเลคตรอนที่สร้างพันธะนั้นต่างกันตรงที่อิเล็กตรอน โดยเดี่ยวนั้นถูกยึดด้วยอะตอมเพียงตัวเดียว ในขณะที่อิเล็กตรอนที่ใช้สร้างพันธะถูกยึดด้วยอะตอม 2 ตัวจึงเป็นผลให้อิเลคตรอนโดดเดี่ยวมีอิสระมากกว่าสามารถครองพื้นที่ในสามมิ ตได้มากกว่า ส่วนอิเล็กตรอนเดี่ยวและอิเล็กตรอนคู่โดดเดี่ยว รวมไปถึงอิเล็กตรอนคู่ร่วมพันธะแบบต่าง ๆ นั้นมีจำนวนอิเลคตรอนไม่เท่ากันจึงส่งผลในการผลักอิเลคตรอนกลุ่มอื่นๆ ได้มีเท่ากัน โครงสร้างที่เกิดจกการผลักกันของอิเล็กตรอนนั้น สามารถจัดเป็นกลุ่มได้ตามจำนวนของอิเล็กรอนที่มีอยู่ได้ตั้งแต่ 1 กลุ่ม 2 กลุ่ม 3 กลุ่ม ไปเรื่อยๆ เรียกวิธีการจัดตัวแบบนี้ว่า ทฤษฎีการผลักกันของคู่อิเล็กตรอนวงนอก (Valence Shell Electron Pair Repulsion : VSEPR) ดังภาพ - อิเล็กตรอนคู่รวมพันธะได้แก่ พันธะเดี่ยว พันธะคู่ และพันธะสาม
ภาพแสดงรูปร่างโครงสร้างโมเลกุลโควาเลนต์แบบต่างๆ ตามทฤษฎี VSEPR
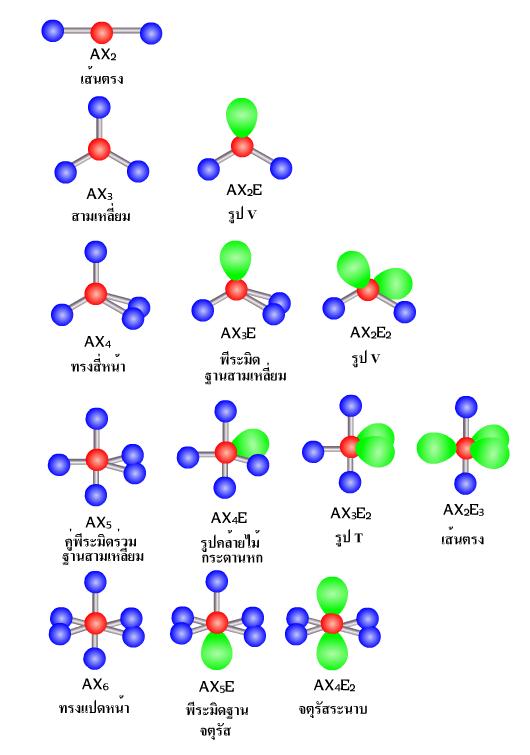
หมายเหตุ A คือ จำนวนอะตอมกลาง (สีแดง)
X คือ จำนวน อิเล็กตรอนคู่รวมพันธะ (สีน้ำเงิน)
E คือ จำนวนอิเล็กตรอนคู่โดดเดี่ยว (สีเขียว)
X คือ จำนวน อิเล็กตรอนคู่รวมพันธะ (สีน้ำเงิน)
E คือ จำนวนอิเล็กตรอนคู่โดดเดี่ยว (สีเขียว)
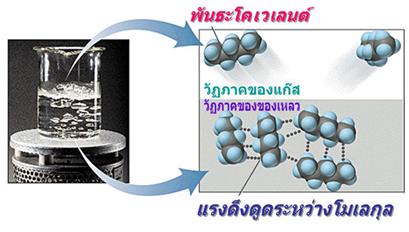
แรงยึดเหนี่ยวระหว่างโมเลกุล ( Van de waals interaction)
เนื่องจากโมเลกุลโควาเลนต์ปกติจะไม่ต่อเชื่อมกันแบบเป็นร่างแหอย่างพันธะโลหะหรือไอออนิก แต่จะมีขอบเขตที่แน่นอนจึงต้องพิจารณาแรงยึดเหนี่ยวระหว่างโมเลกุลด้วย ซึ่งจะเป็นส่วนที่ใช้อธิบายสมบัติทางกายภาพของโมเลกุลโควาเลนต์ อันได้แก่ ความหนาแน่น จุดเดือด จุดหลอมเหลว หรือความดันไอได้ โดยแรงยึดเหนี่ยวระหว่างโมเลกุลนั้นเกิดจากแรงดึงดูดเนื่องจากความแตกต่างของประจุเป็นสำคัญ ได้แก่ 1. แรงลอนดอน ( London Force) เป็นแรงที่ เกิดจากการดึงดูดทางไฟฟ้าของโมเลกุลที่ไม่มีขั้วซึ่งแรงดึงดูดทางไฟฟ้านั้น เกิดได้จากการเลื่อนที่ของอิเล็กตรอนอย่างเสียสมดุลทำให้เกิดขั้วเล็กน้อย และขั้วไฟฟ้าเกิดขึ้นชั่วคราวนี้เอง จะเหนี่ยวนำกับโมเลกุลข้างเคียงให้มีแรงยึดเหนี่ยวเกิดขึ้น ดังภาพ
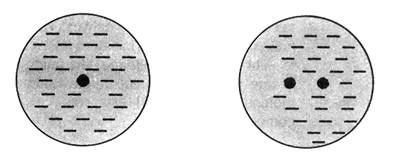
อิเล็กตรอนสม่ำเสมอ........................อิเล็กตรอนมีการเปลี่ยนแปลงตามเวลา
ดังนั้นยิ่งโมเลกุลมีขนาดใหญ่ก็จุยิ่งมีโอกาสที่อิเลคตรอนเคลื่อนที่ได้ เสียสมดุลมากจึงอาจกล่าวได้ว่าแรงลอนดอนแปรผันตรงกับขนาดของโมเลกุล เช่น F2 Cl2 Br2 I2 และ CO2 เป็นต้น 2. แรงดึงดูดระหว่างขั้ว (Dipole-Dipole interaction)เป็นแรงยึดเหนี่ยวที่เกิดระหว่างโมเลกุลที่มีขั้วสองโมเลกุลขึ้นไปเป็นแรงดึงดูดทางไฟฟ้าที่แข็งแรงกว่าแรงลอนดอน เพราะเป็นขั้นไฟฟ้าที่เกิดขึ้นอย่างถาวร โมเลกุลจะเอาด้านที่มีประจุตรงข้ามกันหันเข้าหากัน ตามแรงดึงดูดทางประจุ เช่น H2O HCl H2S และ CO เป็นต้น ดังภาพ
3. พันธะไฮโดรเจน ( hydrogen bond ) เป็น แรงยึดเหนี่ยวที่มีค่าสูงมาก โดยเกิดระหว่างไฮโดรเจนกับธาตุที่มีอิเล็กตรอนคู่โดดเดี่ยวเหลือ เกิดขึ้นได้ต้องมีปัจจัยต่างๆ ได้แก่ ไฮโดรเจนที่ขาดอิเล็กตรอนอันเนื่องจากถูกส่วนที่มีค่าอิเล็กโตรเนกาติวิตี สูงในโมเลกุลดึงไป จนกระทั้งไฮโดรเจนมีสภาพเป็นบวกสูงและจะต้องมีธาตุที่มีอิเลคตรอนคู่โดด เดี่ยวเหลือและมีความหนาแน่นอิเลคตรอนสูงพอให้ไฮโดรเจนที่ขาดอิเลคตรอนนั้น เข้ามาสร้างแรงยึดเหนี่ยวด้วยได้เช่น H2O HF NH3 เป็นต้น ดังภาพ
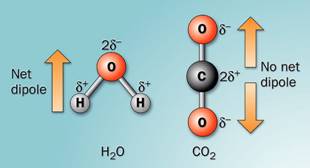
สภาพขั้วของโมเลกุลน้ำและก๊าซคาร์บอนไดออกไซด์
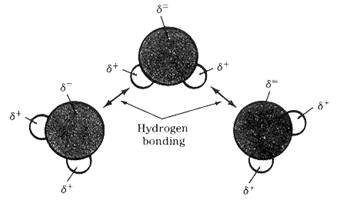
การเกิดพันธะไฮโดรเจนของโมเลกุลน้ำ
สรุปรูปร่างโมเลกุลและไอออนที่ไม่มีและมีอิเล็กตรอนคู่โดดเดี่ยวได้ดังตาราง
สรุปรูปร่างโมเลกุลและไอออนที่ไม่มีอิเล็กตรอนคู่โดดเดี่ยว | ||||||||||||||||||||||||
|
สรุปรูปร่างโมเลกุลและไอออนที่มีอิเล็กตรอนคู่โดดเดี่ยวได้ดังตาราง
สูตร | จำนวนคู่ อิเล็กตรอนโดดเดี่ยว | รูปทรงที่ได้จากไฮบริดออร์บิทัล | รูปร่างของโมเลกุล | ตัวอย่าง |
AX2E | 1 | สามเหลี่ยม | รูป V | SnCl2, SO2 |
AX3E | 1 | ทรงสี่หน้า | พีระมิดฐานสามเหลี่ยม | NH3, PCl3 |
AX4E | 1 | คู่พีระมิดร่วมฐานสามเหลี่ยม | กระดานหก | SF4, TeCl4 |
AX5E | 1 | ทรงแปดหน้า | พีระมิดฐานจตุรัส | BrF3, IF5 |
AX2E2 | 2 | ทรงสี่หน้า | รูป V | H2O, SCl2 |
AX3E2 | 2 | คู่พีระมิดร่วมฐานสามเหลี่ยม | รูป T | BrF3, ClF3 |
AX4E2 | 2 | ทรงแปดหน้า | จัตุรัสระนาบ | XeF4, ICl4- |
AX2E3 | 3 | คู่พีระมิดร่วมฐานสามเหลี่ยม | เส้นตรง | I3-, XeF2 |
วีดีโอการเรียนการสอนเรื่องพันธะโคเวเลนต์